本网讯(生命科学学院 陈学敏)我校生命科学学院陈学敏课题组揭示了V(D)J重组酶RAG抑制致病性DNA转座的分子机制,相关成果于2025年7月29日以“How RAG1/2 evolved from ancestral transposases to initiate V(D)J recombination without transposition”为题在线发表于综合性期刊《PNAS》。生命科学学院陈学敏教授和2024级博士研究生姚良瑞为论文共同第一作者,陈学敏教授和美国国立卫生研究院杨薇与Martin Gellert院士为论文共同通讯作者,安徽大学为第一单位。
V(D)J重组赋予了脊椎动物抗原受体基因的特异性和多样性,而RAG作为其唯一重组酶,负责重组过程中的DNA剪切,其功能紊乱会导致免疫缺陷和癌症等疾病,因此,对RAG重组酶的结构和功能研究将会揭示RAG相关疾病的发病机理,为其诊断和治疗提供线索。RAG属于RNaseH转座酶家族,由HzTransib和BbProtoRAG等转座酶进化而来,而RAG仅保留了对V(D)J重组有用的DNA剪切活性,其致病性转座酶活性被严格抑制,具体分子机制仍不清楚。
研究团队成功利用单颗粒冷冻电镜等技术,捕捉到两种全新RAG信号末端复合物结构:SEC-0和SEC-PHD(如下图)。其中,SEC-0是RAG剪切DNA的最终状态,其总体闭合式构象证明了RAG剪切DNA采取的是一种“Spring-loaded”机制,剪切过程遵循能量由高到低的过程。而在SEC-PHD结构中,首次观察到了RAG核心结构域以外的PHD调节结构域,揭示了RAG通过核心和非核心结构域协同抑制DNA剪切后的致癌性基因转座的分子机制,为相关免疫缺陷疾病的诊断和治疗提供理论依据。另外,也从进化生物学角度,阐明了类RAG转座子通过获取RAG2亚基来增强V(D)J重组活性以及通过获取RAG2的C端非核心PHD结构域来特异性抑制V(D)J重组过程中的致癌性转座酶活性,为转座子的分子驯化提供新见解。
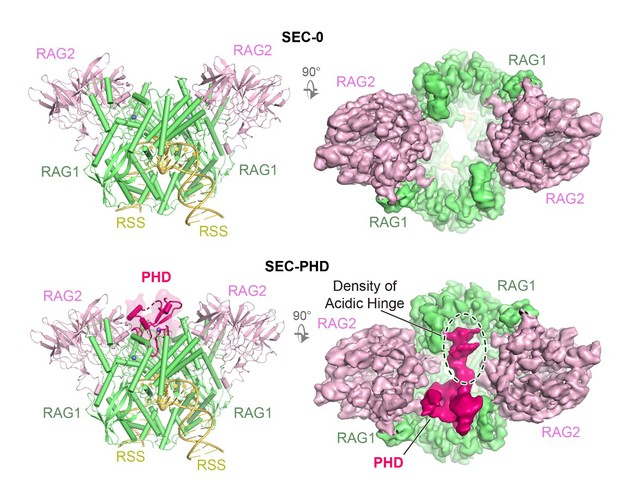
图1:RAG重组酶SEC-0和SEC-PHD的冷冻电镜结构




